摘 要:以美国密理博公司《无菌过滤系统在线灭菌与完整性测试的程序》为蓝本,阐述了无菌过滤系统装置的SIP程序及原理,就一些认识上的误区作了纠正,同时对容器产生的“失稳”现象做了原理分析。
关键词:无菌过滤系统;SIP;滤芯;呼吸器;失稳
《无菌过滤系统在线灭菌与完整性测试的程序》(下简为《程序》)是美国密理博公司的一个技术文件,该公司是1954年成立的世界知名品牌的无菌过滤器生产厂家,在专业方面积累了丰富的经验,故在国际上享有较高的声誉。笔者解读了该《程序》后,在此谈一谈个人的理解,供同行参考。
1《程序》的归纳
从《程序》整个脉络分析,可以归纳如下:
(1)以操作的性质和过程可分为两大类:SIP操作和SIP后、使用前的完整性测试操作;
(2)以过滤器的种类(即操作的对象)分为两大类:疏水型的呼吸过滤器(呼吸器)和亲水型的产品过滤器(微孔膜过滤器);
(3)无论是对疏水型的呼吸过滤器还是对亲水型的产品过滤器即微孔膜过滤器,其SIP离不了几个过程的操作:
进汽排气→灭菌→进气排汽→冷却干燥→保压备用
[说明]:1)“进汽”是指通入蒸汽,“排气”则是利用进入的蒸汽来驱除系统内存在的空气。注意两个“汽”与“气”的区别,“汽”指水蒸汽,而“气”则指空气;2)“灭菌”是通入足够压力的蒸汽来升温保压(也即保温)的过程;3)“进气排汽”,则是通入压缩空气或氮气来驱除系统内的存在的水蒸汽;4)“冷却干燥”是利用通入的氮气或压缩空气来对系统进行冷却干燥;5)“保压备用”是系统应保持一定的正压,因为只有正压之下才能维持系统的无菌状态。
(4)无论对疏水型亦或亲水型的过滤器,在灭菌后、使用前的完整性测试,则可归纳为几个过程的操作:
放空卸压→进液润湿→测试→排放→保压备用(或继续使用)
[说明]:1)“放空卸压”是为了让系统与外界压力平衡,以便下一步的“进液润湿”操作;2)“进液润湿”则是使滤芯浸润,这是进行完整性测试前的必要准备;3)“测试”,以规定的仪器按一定参数条件操作,获得相应期望的可靠性结果;4)“排放”,使充满在过滤系统里的液体排出;4)“保压备用”(或继续使用),测试通过暂时不用时需保压备用,若继续生产则可投入使用。
2对《程序》中无菌过滤系统装置的理解
《程序》开始的 (如附文图1)列出了医药行业最典型的配液无菌过滤系统的装置,即由无菌容器——通常所用的配液罐或纯水罐等、容器上所安装的呼吸器(“呼吸过滤器”原文为 vent filter)及产品过滤器(“微孔膜过滤器”,原文为product filter)这3种最基本的器件所组成。虽然,在制药过程中各品种乃至各厂家工艺流程不尽相同,但这三种基本的设备配置在生产流程中几乎都是必不可少的。即罐、罐上的呼吸器和微孔膜过滤器。因而此装置对于众多的制剂企业应该是相当之熟悉,所以具有普遍而典型的借鉴意义。
从《程序》的结构和出发点来理解,主要是给我们列示了无菌过滤系统装置在线灭菌的程序,还有灭菌后,在下批次生产前对过滤系统的完整性测试的全过程操作。步骤比较详细,从专业的角度来说,确实值得我们借鉴和学习。
从字面上而言,现在业内人士普遍对在线灭菌(SIP),应该说基本上知道的,但如果谈到SIP的实质,能读透和理解的可能就少之又少了。
以无菌过滤器的滤芯(膜)的材料为例,有疏水型和亲水型的两种。疏水型的适合于气体的过滤,而亲水型的则更适宜液体的过滤。
疏水型而言,如通常应用在容器的“呼吸器”上的聚四氟乙烯(PTFE)等,其作用是平衡容器的内外压力差,亦即使容器内与容器外大气压力平衡。这是由于通常制剂行业的不少容器并不需要“带压”操作。所以,常压的容器在“进料”(如加入注射用水)操作时,为了能使液体加入容器的同时使容器里占据空间的气体(如空气)能够排出,而不致影响进料,这就需给这些气体一个出路,这就是呼吸器的作用;而当容器内的物料完成了在容器里的工艺过程(如配料中的加热、溶解、混合、冷却等)后,需要输出时,特别是用泵打出时,由于罐内液体容积的减少,占据罐内的空间也减小了,造成空间的“缺位”。如果这时罐内不与外界相通,势必形成罐内压力的降低,即真空状态。这种状态有两个弊病:一是使泵的出料不畅,影响出料的速度和生产效率;二是使罐体承受外压(真空)而有“失稳”(抽瘪)破坏的危险。所以,此时罐上的“呼吸器”就可以让外界的空气由于罐内压力的降低而进来补充,起到了“吸”纳空气的作用,平衡了罐内外的压差,消除了上面所说的可能出现的两个问题。由于呼吸器实际上是一个无菌过滤器,在让气体自由通过的同时,又阻隔了细菌和杂质微粒的作用,得以保持罐内的洁净,即无菌状态,不致因气流的平衡流动受到外界的污染,从而符合GMP。如果在操作上是带有压力的容器,比如是利用压缩气体(空气或氮气)的压力来输送流体物料的,虽然在压料时与外面大气是隔断的,但在放空操作需要达到与大气压平衡时,呼吸器也起到了与上面所述的类似的作用。
而大家所熟知的微孔膜过滤器(《程序》中为产品过滤器)则是用来过滤去除料液中的微粒或微生物,使之达到工艺要求的“除菌”过滤器。由于这种过滤器一般用于过滤液体,而液体又以水溶性居多,故为了减少过滤阻力材料多用亲水型的。
3对《程序》中过滤系统的清洗灭菌的理解
过滤系统在一个生产周期完成后必须进行清洗、灭菌处理,才能进行下一批次的生产。在线清洗又称为CIP,这是SIP前必须经过的程序。这里假设已经按GMP要求完成。而SIP的一系列操作是关系到系统是否最终真正达到始终保持无菌的要求,所以在操作程序中显得较为详细。
《程序》首先将容器和呼吸器放在一个系统里讨论,而将微孔膜过滤器列至后面讨论。这是由于容器和呼吸器联系比较紧密,实际上可以认为呼吸器就是容器(罐)上的一个附件,呼吸器是疏水型的,但微孔膜过滤器则是亲水型的。两种过滤器的材质和工艺功能不同,对其SIP和完整性测试的方法也有差别。所以《程序》中分别予以讨论。
应该注意无论哪种过滤器,在系统灭菌过程中原则上都必须做到:
(1)原系统内空气及残水和蒸汽凝水都必须及时顺利排放出去,这主要是防止系统内不凝性气体残留在腔体内影响承担着灭菌作用的蒸汽的穿透力,从而削弱灭菌的效果。灭菌蒸汽在灭菌过程中所产生的凝水也必须及时排出。否则,因为凝水的温度一般都达不到灭菌要求的最低温度(即121.1 ℃),使得形成温度的“冷点”死角,同样达不到彻底灭菌的要求。
(2)其操作程序中对阀门的开启是很有讲究的,如用了“全开”、“微微开启”和“慢慢打开”、“分别开启”等词语。读者可以对每一操作步骤细心去体会,这将会对加深理解大有裨益。例如,“微微开启”的操作往往是控制排放阀让汽和凝水形成细流不断排出,这样的目的在于既不致使系统和容器内积存有蒸汽的凝结水而形成温度的死角,又不让高温蒸汽大量外泄造成能源的过度消耗和威胁人身安全。
(3)注意灭菌时间的计算,应当从温度最低点的位置测量点(附文图上的T1、T2和T3)达到121.1 ℃时开始计算,如30 min等。这个时间是需要各企业根据实际情况验证的,而不是从系统蒸汽阀门打开时开始计算。这样就保证了最迟达到灭菌温度的区域有足够的灭菌时间而达到灭菌的要求。
(4)灭菌结束后,应往系统中通入无菌压力气体(无菌空气或氮气)以置换出系统中的蒸汽并使系统冷却和干燥(附文图2中的“冷却与干燥”,图5中的“冷却”)。这个程序一般是不应该省去的,而我们国内有的厂家往往图省事而忽视或干脆取消这个操作,他们觉得“灭菌”已经结束,达到了“无菌”要求,为了赶时间,上产量,于是马上进入生产状态。开始往系统里如罐类容器中加料。殊不知,这时系统里充满了很热的饱和水蒸汽,而料液一般来说温度较低。一加进来,使充满容器内的蒸汽骤然冷却,产生“相变”(由“汽相”到“液相”)成了凝水,瞬间大大缩小了体积,形成真空负压的状态,使容器被大气压所“压瘪”,即专业上所称的“失稳”现象,造成设备损坏。例如,苏北某大型制药企业近年就先后出现过2台10t的纯化水罐灭菌后因操作不当而瘪掉不得不报废的情况。这虽然只是个个案,但从原理上推论,所有在工艺过程中需要灭菌而带有灭菌系统的容器类设备都有发生类似事故的潜在危险,因此,这不是一个特例,而是包含了数量颇为可观的一类罐子设备群体。这就很值得许多药厂引以为戒。所以,灭菌结束后不能忽视这样一个对系统(设备)作“缓冲”——用洁净的压力气体(空气或氮气)驱除蒸汽并使系统冷却的过程。不然的话,就要等待较长的时间让其自然冷却。
(5)由于过滤器的关键元件滤膜(滤芯)是易损元件,而灭菌过程是处在较高温度和一定压力状态,这也是使滤膜可能受到损坏的重要原因之一。为了验证此时的系统是否存在缺陷(如滤膜是否完好无损,系统的密封性可靠与否等),就必须强调进行所谓“完整性”的测试。这种测试,不仅仅是对初次购进的滤芯而言,也不仅仅是对单独的滤芯元件而言。它既是对整个系统的完整性测试,也是对系统每(批次)次使用前必须进行的程序。而且一定要“在线”实施。否则就不能称为真正意义上的“完整性测试”。这种理解是很好解释的。当然不同型号、材质和用途的产品各有不同的测试参数、方法和条件。例如,密理博公司对疏水型的过滤器有专门的称为‘HydroCorr’的测试,而对亲水型的过滤器则是采用称为‘Enhanced Bubble Point’测试。但不管用何种测试手段和方法,总而言之,这一步骤是必要的,是保证产品质量的关键。
(6)操作过程中对压力差的控制是一个重要的关键。包括在线灭菌及完整性测试操作过程中的压力差的控制。不同型号的过滤芯规定有不同的压力差,即使同一滤芯,正向灭菌(指蒸汽的流向)和反向灭菌的压力差应有所不同,润湿的溶媒不同时由于表面张力的变化,完整性测试的压力也会不一样。
(7)注意实施操作过程中的安全,《程序》对安全的防护十分重视,7条准备条款中2条专门涉及。且单独列出了要设立警示标志,防止烫伤,并强调操作人员要戴防护眼镜,必要时还要戴防护手套。这是由于灭菌过程中温度比较高,设备和管道系统如果一些地方没有保温层是很危险的,所以这一点必须加以强调。
4对《程序》总体解读感
读了密理博公司过滤系统SIP及SIP后和使用前完整性测试的操作程序起初总的感觉其装置设计比较复杂,但细细琢磨又不无道理。与我们现今生产厂家的设备的安装流程相比较实在是“繁”多了。
就拿罐上的呼吸器来说,我们很多厂就是设备上封头一个接管上面装一个阀门,再上面装个呼吸器就得了,仅此而已。而按密理博的做法,仅这个呼吸器在线完整性测试就安装了6个阀门,还未算上罐子和与之相联接的管道上的需要相配合使用阀门及压力罐(见附文图2)。而且就要安装在这个呼吸器旁管路上,还不能随便拆掉。因为按在线的概念,它们就是一个系统,一个整体。否则就破坏了“在线”这个定义了。
而对产品过滤器亦即我们所指的微孔膜过滤器来说每个过滤器的相配套阀门有12只之多(见附文图4、5、6)。如此说来,整个管道系统就显得比较的复杂,因而造价也就不菲。当然在操作上步骤也就不少。
但是,谁又可以保证不如此做而能得出整个无菌系统可靠性的结论的成立?这在当今实是一个比较矛盾的事。因为大家读了译文的以后,拿他们的做法与我们当今绝大多数药厂来比较,差别的确很大。如果有人做到没有那样复杂的装置而保证能达到系统可靠性的结果,这可是一个了不起的创新!但我们的企业目前如此较为简单的装置也个个通过了GMP的验证,这其中是不是有些值得我们研究和质疑的地方?我们往往在出现了事故而且造成比较严重的后果才去反思,去研究,去追溯,去调查。当然,亡羊补牢并不是不对,但用“亡羊”,甚至于比之大很多倍的损失和教训来换取“补牢”的行动,代价委实就太大了!但我常听到药厂的设备采购人员问药机厂:你们的罐子能否做到SIP,能通过GMP验证吗?药机厂的人很干脆的回答:你不看到罐子的图纸的接管表有个“纯蒸汽进口”吗?按照这种粗放式的理解,罐子上有个纯蒸汽进口就算是符合SIP而可以通过GMP了?这也太简单了吧!实在是非常“简洁”的解释。而这种解释也居然能被药厂的设备采购人员所接受。可见我们对SIP的理解是多么的肤浅。当然对采购人员专业的要求与对药厂工艺技术人员的要求相比不可相提并论,但制药企业工艺技术人员能对灭菌了解得比较深透的还不多。
附文:美国密理博公司无菌过滤系统在线灭菌与完整性测试的程序
MILIPORE TECHNICAL BRIEF—Steaming-in-place and integrity testing of a sterilizing-grade filter assembly
(陈晓东 郇 霞译)
此项技术简介的目的在于为读者提供一套典型的蒸汽灭菌及完整性测试的标准操作程序(SOP)。这是由于蒸汽灭菌是导致过滤器失效最常见的原因,因而在此针对无菌级过滤器介绍灭菌过程以后及产品过滤前测试其完整性。这套SOP是针对呼吸过滤器和产品过滤器这二种过滤器,它既包含有在线灭菌(SIP)亦有在线灭菌后及使用前在线完整性测试的整个过程(如图1所示)。此SOP的操作包括以下方面: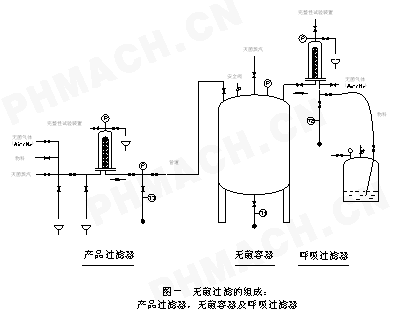

(1)疏水性过滤器系统SIP的组成,像Millpore’s Aervent CTGR 5in或10in,或LAGR 4in装置,是用于有放空(呼吸)无菌容器的场合(呼吸过滤器,译者注)。
(2)对呼吸过滤器在线灭菌后及使用前的完整性测试。
(3)亲水性无菌级过滤器系统SIP的组成,像Millpore’s Durapore CVGL 10in,LAGL 4in或者MCGL装置,是用于产品(亦即物料,译者注)的无菌过滤场合(产品过滤器)。
(4)对产品过滤器在线灭菌后及过滤使用前的完整性测试。
对疏水型呼吸过滤器SIP以后,过滤前的完整性测试,是指HydroCorr的专用测试。这种HydroCorr测试只需用清洁的水,它不同于经典的如分散和起泡点过滤器的测试程序,其所用的是乙醇与水的混合物来浸润的。由于,此种测试是在呼吸过滤器的上部而不要求在其下部进行操作,因而完全适用于对过滤器的完整性评价及SIP的在线灭菌过程,且不致损坏呼吸过滤器。
对SIP后、过滤使用前的对亲水型产品过滤器的完整性测试是一种所谓“增长的泡点测试”(the Enhanced Bubble Point test)。
完整性测试包括:对过滤器用标准湿润溶剂的浸润,及因灭菌而对过滤系统无菌状态所产生破坏的可能性判断。与无菌容器相联接的呼吸过滤器与产品过滤器是一个全封闭的、密封性完整的无菌系统。用于浸润过滤器的水在进行完整性测试前不能从密封的过滤系统底部排放掉,而须留在无菌容器内。由于物料可直接通过所盛装的容器,所以用过滤的物料作为湿润剂来用作过滤器使用前的完整性测试则可避免测试溶媒由装置底部排放。
物料的泡点测试完全适用于过滤器的完整性测试,而且适用于SIP的全过程,这种方式不会损坏过滤器。
1过滤器的特性
Millipore’s Aervent 过滤器是无菌级的呼吸过滤器,其滤膜材料为聚四氟乙烯(PTFE)。该种过滤器是在135℃下,经历30min,至少40次SIP的正向和反向循环测试检定的(见相关过滤器的验证指南)。正向SIP的允许最大压力差为350mbar,而反向完全SIP循环最大压力差为100mbar。
Millipore’s Durapore 过滤器是由聚偏氟乙烯(PVDF)作为滤膜的材料。该过滤器在135℃,经历30min,至少经过5至30次SIP的正向循环测试检定(见相关过滤器的验证指南)。在正向SIP时所允许的最大压力差为350mbar。
2完整性测试参数
SIP的基本参数如表1所示。
0.22μm 无菌级的亲水型Durapore过滤器在纯水浸润5分钟,压力差为200mbar时,其最小泡点值为3450mbar。表2为Durapore 型过滤器作起泡点试验所要求的浸润体积。
物料的最小泡点是通过实验室的泡点率仪来确定的。这种泡点率(BPR)方法是一种用来测试非标准浸润液体的最小泡点值的(见Millipore’s 应用手册,No.AN1505EN00)。
对HydroCorr测试的过滤器壳所推荐的压力为1barg。表3列出的是对Aervent型号的过滤器所用HydroCorr 完整性测试标准。
3对安装有呼吸过滤器的无菌容器的蒸汽在线灭菌程序
手工操作的SOP在下面一一给出,而对于自动控制的SIP则可参考本公司的NO. TBO11ENOO技术简介。
下面的条件是在线灭菌前要做到的:(1)容器和与之相联接的管道已清洁并处于空置状态;(2)正确选用合适的呼吸过滤器并将其安装好;(3)检查所有的联接件均固定妥当;(4)通过压力测试检查了系统无泄漏;(5)硅胶管与排放阀相接能直接排放凝水且关闭所有阀门;(6)使用警告标志,以避免触及蒸汽和烫的不锈钢表面;(7)始终要戴防护眼镜,必要时戴隔热的防护手套。
3.1标准操作程序
标准操作程序(如图2所示):
(1)检查(灭菌)蒸汽及压力气体(空气、氮气)的压力是否位于在相应安装的阀门处(如图2中的‘准备装置’,译者注)。
(2)分别打开阀门V2、V3、V4、V5和V1,让蒸汽进入系统且将系统内空气清除。
(3)部分关闭排放阀V2和V5,使得容器内压力至少升至0.5bar,等到温度计T1和T3升至超过100℃。
(4)然后,慢慢打开阀V6使蒸汽通过呼吸过滤器。微微开启排放阀V7和V8使蒸汽形成稳定的流动并让凝水及空气从过滤器腔体中排出。注意:控制压力表P1和P2间的压力差及在过滤器之间保持一个最大的△P值为100mbar,这是十分重要的。而对于相反方向的SIP,则要用Optiseal或者code7* 过滤器,而不用code 0** 过滤器。
(5)确保所有空气和凝水能通过微开的阀门V2、V5、V7和V8排放,因此可以见到15cm长的水与汽的细流在连续排出。
(6)当系统在温度计T1、T2和T3测量的温度达到121.1℃时,开始计算灭菌时间,其不得少于30分钟。若温度有所下降,则时间还要长一些(以上(2)-(6)见图2中的‘灭菌过程’,译者注)。
(7)当所需的灭菌时间达到时,关闭蒸汽供给阀门V1,缓慢开启阀V9使压力气体进入系统。注意:确保系统处于正压(通过压力表P1、P2和P3的指示)且控制过滤器间的压力差△P不超过350mbar。


(8)由所有排放阀使蒸汽排出,关闭阀V7和V8增大通过系统的无菌压力气体的流量。控制气体的流量来使系统冷却到到温度计T1、T2和T3的指示温度约40℃。
(9)分别关闭阀V5、V2和V4,保持阀V6和V9打开状态以维持持整个无菌系统处于下压状况,即使系统不使用,这个状态仍应维持(以上(7)-(9)见图2中的‘冷却与干燥’,译者注)。
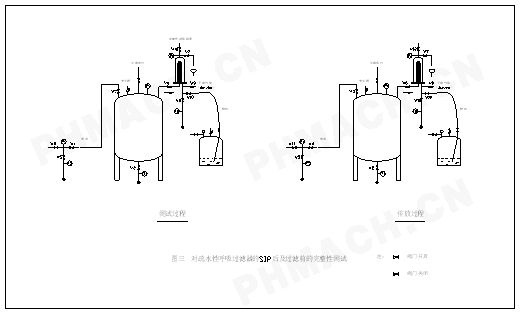

3.2灭菌后,使用前呼吸过滤器的完整性测试程序
灭菌后,使用前呼吸过滤器的完整性测试程序(如图3所示):
(1)关闭压力气体阀门V9,保持阀V6开启,打开阀V7使系统放空。等到压力表P1和P2下降到与大气压相等。
(2)让压力容器盛满洁净的纯水并使容器的进料管通入1bar压力气体,将容器出口管与阀V10相联接。
(3)慢慢打开阀V10让水进入过滤器腔体而空气不能进入(如是空的容器),确保过滤时的压力不超过1bar,继续过滤到能看到与阀V7相联的软管有水溢出。注意:当过滤器壳体安装在很高的容器顶部上方时,可有力证实过滤时通过加压可调节因重力而产生的影响。
(4)关闭V10,缓慢打开容器顶部放空阀,让空气从容器内排出,直到其与大气压相等。
(5)关闭V7,打开V12,并将过滤器完整性自动测试装置与V12相连接。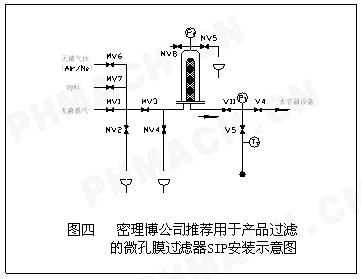

(6)复查一下:V6开启,而V7、V8、V9和V10为全关闭。此时进行HydroCorr测试(以上(1)-(6)见图3中的左图‘测试过程’,译者注)。
(7)当测试完成,则得到正相关结果(即通过)。此时关闭V6和V12,断开与其相连的过滤器完整性自动测试装置。
(8)打开V7和V8,使水从腔体中排出。此时可小心打开V9,通过加压来让排放更快些。这样,直到系统排空。
(9)完全打开V9,持续30min,让过滤器干燥。
(10)关闭V7和V8,打开V6,保持V9开启。这样,在不使用(过滤器)时让系统处于正压的状态之下(以上(7)-(10)见图3中的右图‘排放’,译者注)。
4产品过滤器的在线灭菌程序
产品过滤器的在线灭菌程序(如图4所示)。
手工操作的SOP在下面分别列示。自动控制部分的SOP请参照本公司No. TB11ENOO技术简介。在线灭菌操作前应做到以下几点:
(1)过滤器壳体安装好,合适的滤芯置于恰当的位置;
(2)过滤器是干燥的;
(3)与排放阀相联接的硅胶管可直接排放凝水。所有阀门处于闭合状态;
(4)使用警告标志,以避免接触蒸汽和烫的不锈钢表面;
(5)始终应戴防护眼镜,必要时要戴防护手套。


4.1标准操作程序
标准操作程序(如图5所示):
(1)检查(灭菌)蒸汽及压力气体(空气或氮气)的压力是否已在相应安装的阀门处。
(2)打开阀MV1和MV2,排空蒸汽管路中所有凝水。
(3)全开阀MV4和MV5,使空气和凝水排空。
(4)慢慢开启阀MV3,逐渐让蒸汽进入并加热过滤器。
(5)部分关闭排放阀MV2、MV4和MV5,以使可见汽与水的细流。
(6)打开V11后,微开排放阀V5,使凝水、蒸汽及空气从过滤器腔体中不断排出。注意:控制压力表P3与P4之间的压力差△P,使之保持在一个最大值为350mbar,此为十分重要。
(7)确使所有空气与凝水能不断通过阀MV2、MV4和微启的MV5排放掉,如此可见有15mm长的细水流在持续排放。
(8)当处于过滤装置底部的温度计T3所显示温度达到121.1℃时方开始计算灭菌时间,其不少于30min,甚至更长些,以确认其有效。灭菌的温度和压力值应按规定记录(以上(1)-(8)见图5中左图‘CIP操作’,译者注)。
(9)菌结束时,关闭蒸汽进汽阀MV1,缓缓打开阀MV6,让压力气体进入系统(见图5‘冷却操作’)。注意:确保系统处于正压状态(通过压力表P3和P4指示),并控制过滤器两端压力差△P不超过350mbar。
(10)让蒸汽从各排放阀排出。关闭阀MV2和MV4以增大通过系统压力气体的流量。控制压力气体的流量使系统冷却到温度表T3的指示温度约30℃。
(11)分别关闭阀V5、V11与MV5而使MV6和MV3保持开启,让系统不使用时处于正压(以上(10)-(11)见图5中右图‘冷却’,译者注)。
4.2 SIP后,过滤使用前完整性测试程序


SIP后,过滤使用前完整性测试程序(如图6所示):
(1)确使阀V3、V6及呼吸过滤器上的V7处于开启状态,并且联接有产品过滤器的无菌容器底部是处于与大气压相同的放空状态。(V3、V6、V7的位置见图2或图3,译者注)。
(2)打开阀MV3,关闭压力气体阀门MV6且打开阀MV5使系统处于放空状态,等到P4指示压力降至大气压力。
(3)有可能的话,使进料口压力达到2.8bar。逐渐开启阀MV7,让滤器腔充满料液并使上部空气由放空阀MV5排出。
(4)当料液溢至阀MV5时,关闭MV5,继续保持2.8bar压力至少1min,使过滤器中残存气体溶解并使过滤膜润湿。
(5)将底阀V11全开,渐开阀V4,让P4与P3间形成大约200mbar的压差。
(6)继续让物料在适当压力差的推动下从产品过滤器过滤到无菌容器,其时间至少5min(以上(1)-(6)见图6中的左图‘浸润湿’,译者注)。
(7)然后关闭阀MV7和MV3切断过滤,将阀V4全开。
(8)打开阀MV8,联接至过滤器完整性自动测试装置。
(9)复查MV8、V11、V4、V3、V6与V7处于开启状态,并使MV3和MV4全关闭,进行起泡点的测试(以上(7)-(9)见图6中右图‘泡点测试’,译者注)。
(10)当测试结束并得到正相关的结果(即通过),关闭阀MV8,断开过滤器完整性测试装置。
(11)打开阀MV7、MV3和MV5重新开始过滤。
(12)当物料由MV5溢出时,关闭MV5,继续物料的过滤。
作者简介:陈晓东,男,高级工程师,南京金日制药装备有限公司总工,研究方向:化工及制药设备的设计和制造。
本文改编于:陈晓东. 解读《密理博公司无菌过滤系统在线灭菌与完整性测试的程序》、美国密理博公司无菌过滤系统在线灭菌与完整性测试的程序(译文).中国制药装备[J].总41期.2009(1)