[摘要]:本文从工程实践的角度分析发酵生产过程的控制机理以及采用霍尼韦尔公司新型混合控制系统对工业化大生产的发酵过程进行参数控制的实用技术。
[关键词]:医药生产过程、发酵、控制系统。
一、前言
计算机自动控制技术在我国医药发酵工业大生产上的应用基本上开始于上个世纪70年代中后期,之后随着计算机技术、传感器技术和执行器技术的不断发展,尤其是到了80年末期,由于抗生素主要品种──青霉素新菌种的引进,青霉素丝状菌工艺要求营养剂必须连续补充,传统的手动集中补料的模式已不能满足新工艺,从而对抗生素发酵生产过程自动化控制提出了迫切的要求。可以说发酵工艺的改进或新工艺的需求是计算机自动控制技术在生产过程应用的重要内因,而且这一内因仍然是以后计算机综合技术在发酵生产应用上不断上台阶的源动力。
到目前为止,计算机自动控制技术在医药行业应用最成功、取得经济效益最明显的工段当属发酵过程,基本上实现了如下参数的检测和控制:
·检测参数
(一)各级发酵罐
发酵和消毒温度、发酵液pH值、罐顶压力(即排气压力)、空气流量、溶解氧含量(DO)、发酵液体积(称重)、尾气二氧化碳和尾气氧含量、搅拌速度、电机电流、泡沫位置、移种量、带放量等。
(二)公用工程
①空气总管温度、空气总管压力、空气总管流量(积算)、空气总管湿度、环境湿度
②蒸汽温度、蒸汽压力、蒸汽流量(积算)
③溴冷水进口温度、压力、溴冷水出口温度、溴冷水进口流量(冷量积算)
④冰盐水进口温度、压力、冰盐水出口温度、冰盐水进口流量(冷量积算)
⑤循环水进口温度、循环水进口压力、循环水出口温度
⑥恒温室、种子组的温度、湿度
·控制参数
多种营养剂流加补料(如青霉素发酵中的糖/硫铵/苯乙酸/玉米油/氨水)、发酵温度、发酵液pH值、消泡加油、通气量、罐顶压力、溶解氧、电机转速、连消控制等。
·检测、控制精度
参数检测精度:±0.2%满量程
温度控制精度:设定值±0.5℃
PH控制精度:设定值±0.05PH
补料控制精度:±2.0%
空气流量控制精度:±2.5%
罐压控制精度:设定值±0.005Mpa
二、发酵过程控制机理简析
(1) 温度:
在发酵的环境条件中,温度是最基本也是最重要的条件之一。温度升高能加强酶的活性从而影响微生物的生长速率,一般而言温度每增加10℃,增长速率近似地增加一倍。如果生长温度高于最佳温度,生长速度随温度的上升而很快下降;如果超过最高限度的温度,微生物会在很短时间内死亡。如果生长温度低于最适温度,生长速度减慢。过高或过低的温度都会使细胞中某种酶的活性减低或丧失。在最佳温度,微生物的代谢时间最短,生长速率最大,活菌数增加最快。温度不但影响微生物的生长速度,而且影响产品得率。最佳温度应依据不同发酵阶段中酶的特点确定。合成菌体细胞物质和合成发酵产物的酶类,其最适宜温度和最适PH值可能不同,由此反映出发酵过程的生长为主阶段和产物生成为主阶段的最佳温度和最佳PH值不同,所以不同发酵阶段应分别确定最佳温度。由于发酵罐温度十分重要而温度测量的成本相对PH、DO等参数来说低廉得多,根据实践经验,为保证测量和控制的不间断性,设置两个罐温测量点,对于150m3以上的大罐按上/下方式布置;对于150m3以下的大罐按同一水平方向布置。一般情况下,两只传感器能反映发酵罐内温度均匀程度,而且只要其中任何一只传感器能可靠工作,就能保证生产正常运行。另外,为监测冷却水的冷却效果,在冷却水进口和出口分别设有温度传感器。
为提高温度检测的精度和增强抗干扰能力,尤其是采用变频搅拌的罐体,强烈建议选用一体化温度变送器,把温度信号就地变换成电流信号后远传给控制室的控制器或相应仪表。
一般而言中小罐温度控制过程既有升温过程也有降温过程,在培养初期和寒冷冬季,散热量大于产热量时,需要保温甚至升温;而当产热量大于散热量时则需要降温。
在工程实践中,对于10m3以下的种子罐,我们采用气动开关阀控制其温度,而且摒弃了传统的热水罐,直接采用蒸汽控制来进行保温和升温。可以省掉一般设计的热水系统,一方面节约了投资,另一方面减少了相应的管路安装空间。
和传统的调节阀温控系统相比,该阀门具有体积小、安装方便、成本低、控制准确等特点,而且一次性投资少、维护运行费用低,是我公司针对医药行业特点而设计研制的新型产品,具有国内领先水平。在多家生产企业得到了广泛应用,取得了满意的效果。
中小罐温度控制示意图如下:
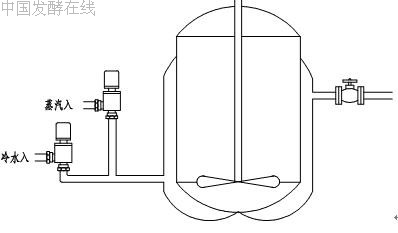
发酵大罐的温控一般仍然采用传统的调节阀方式。对于有多种冷却水的大罐,为充分节能降耗,在工程实践中可以采用多个自动阀分别安装在各自对应管路上,由控制系统自动根据环境温度和培养温度。
(2) 碳源等营养物质:
当发酵葡萄糖的浓度为中等偏低时,微生物的生长和代谢物的生成受到初始葡萄糖含量的限制,不可能获得较高的代谢物产量,解决的办法是初始培养基中的葡萄糖含量为中等或偏低,并在发酵中途采用流加方式补充浓缩葡萄糖,使葡萄糖的含量维持在最合适的范围,使最终产物达到最佳值。
葡萄糖的流加有两种方案:
a. 葡萄糖断续流加:优点是工艺操作简单,可以人工控制,缺点是培养基中葡萄糖的含量波动较大,不利于微生物的生长和发酵产物的生成;
b. 葡萄糖连续流加:优点是培养基中葡萄糖的含量波动小,能够控制在最佳的含量,利于微生物的生长和发酵产物的生成,缺点是工艺操作复杂,必须用自动控制设备控制。目前在发酵生产过程中最基本也是最主要的控制内容之一就是采用葡萄糖连续流加方案。
葡萄糖的流加有两种方式:
a. 补料杯方式,其方案的优点:成本低,易于实现,几乎是小补料量的唯一方式;其缺点是管路复杂,消毒困难。
b. 电磁流量计和开关阀,其方案的优点:管路简单、消毒彻底;缺点是不适用于小补料速率。
为了控制各种营养的流加,需要测量发酵液量,可采用发酵开始前用手工方式输入到控制计算机中,也可采用发酵罐液位(称重)测量的方法来实现计量。
其它营养物质的流加同葡萄糖之控制。
(3) PH:
在抗生素发酵过程中,微生物分解利用各种营养物质,产生各种分解产物,也迅速改变发酵液的PH值。而对于大多数抗生素而言,最适宜菌丝体生长和抗生素合成的PH值应是接近中性,PH过酸或过碱时,一方面使得抗生素合成途径被干扰,抗生素合成受到抑制,另一方面过酸或过碱的发酵液会使得某些抗生素产生降解反应,造成抗生素的失活。因此,欲使抗生素高产,提高发酵单位,就必须把发酵液PH值稳定在一个合适的范围。另外,采用人工手动进行加碱时,会出现一次性加碱量过大,碱性物质与菌丝细胞局部过量接触,会导致菌丝受损死亡。而只有采用计算机控制加入量,才可达到多次少量,把菌丝体局部与碱性物质接触量降到最低限度,有利于发酵单位的提高。
为了减少对发酵罐的定容的影响,并降低生产成本,根据有关工厂的实践,我们建议采用液氨作为调节PH的物质并通过空气总管流加。同时为了提高系统关键点的可靠性,采用一个常闭阀和一个常开阀串接的控制方式,即正常情况下常闭阀作为液氨加入的主控阀调节其加入量;而常闭阀则作为保护性阀门,当主控阀失效时自动关闭以防止因过量液氨的加入而造成的灾难性后果。
发酵过程中酸碱度的检测采用PH值传感器,这种传感器必须能够经受发酵罐的高温灭菌,并可准确连续不断地测量发酵罐内酸碱度的变化。
(4) 风量、搅拌、溶氧
在发酵中微生物的生物氧化过程需要供给足够量的氧,供氧不足严重影响微生物的生长与代谢产物的合成。因为微生物的氧化酶存在于细胞原生质中,所以只能利用溶解氧。微生物不断地消耗掉发酵液中的溶解氧,同时在发酵液中不断地通入无菌空气予以补充,使整个发酵过程中"供氧大于耗氧"。但氧是难溶于水的气体,纯氧在32℃、0.1Mpa气压下在纯水中的溶解度仅为36ppm, 空气在32℃、0.1Mpa气压下在纯水中的溶解度仅为7.6ppm。在不同性质与不同浓度的培养基中,氧的溶解度也不同。氧在水中的溶解度与其他其它气体存在无关,只与气相中氧的分压成正比。空气中氧气的含量体积比为21%,故在0.1Mpa气压下,空气的氧分压为0.021Mpa气压。当发酵液的罐压提高时,气相中氧的分压也相应提高,溶解氧浓度也增加。例如赖氨酸发酵时,当用10%糖浓度的培养基,操作罐压为0.1Mpa表压(0.2Mpa绝对压力)时,溶解氧浓度为8ppm。各种微生物的呼吸强度是不同的,而且呼吸强度随着培养基中溶解氧的浓度而加强,到一个临界值为止,该临界值称为临界氧浓度。在整个发酵过程中并不需要氧的浓度达到饱和溶解度,但必须保持在临界氧浓度之上,提高培养基中氧的浓度,使菌能达到最大呼吸率,对产物形成有利。
在发酵罐中,氧的供给是通过向发酵中通入无菌空气并利用机械搅拌混合,提高氧的溶解能力。由于微生物生长的各个阶段对于氧气的需求量不同,在发酵的后期氧气的需求量逐步降低。因此在发酵的各个时期,可以采用不同的供氧量(通风量),以达到降低成本减少泡沫的目的。同时要调节发酵罐中溶解氧浓度也必须通盘考虑搅拌器转速和通气量,才能取得更好的效果。
为降低成本和避免染菌,空气流量计和控制空气流量的调节阀均安装在进气管上预过滤器前。
(5) 泡沫:
泡沫的持久存在会影响发酵罐的装料量,使菌体上浮,妨碍二氧化碳的排出,不利于代谢活动正常运行;严重时影响通气、搅拌、妨碍氧气的溶解,造成代谢异常,从而导致产物产量下降和菌体提前自溶。泡沫多时还会造成发酵液从排气管逸出,或上升到罐顶从轴封处渗出,增加染菌机会,因此必须及时消泡。
在发酵过程中泡沫是客观存在的,一方面与通气、搅拌剧烈程度有关,搅拌比通气更易产生泡沫;另一方面与培养基原料性质有关,蛋白质原料是主要的起泡因素,灭菌时间越长,泡沫越稳定。另外泡沫与菌体代谢产生气也有关系。
为消除泡沫对发酵的影响,发酵生产都采用消泡剂,借水使消泡剂分散,消泡剂的小滴渗入细胞间的液膜内,使液膜形成双层膜,或与液膜结合成新单层膜,从而改变了液膜的张力和粘附力,引起气泡破裂。
在发酵生产中,为了防止泡沫大量持续存在而影响发酵进行和降低发酵水平,需要减少泡沫生成。在发酵的前期采用小的通风量,并通过监测排气中氧的利用率来控制通风量,在发酵中后期泡沫量大而消泡剂效果小时,可适当提高罐压,降低通气量,甚至短时间间歇性的停止搅拌,减少泡沫的生成;另外采用我中心研制生产的双液位防污染泡沫电极可准确检测到泡沫的位置,一旦泡沫量较大时,延迟一段时间后,自动释放泡剂。
(6) 罐压:
发酵罐内维持一定的正压,其主要目的是为了防止外界空气进入发酵罐内,造成污染;另一个目的是为了增加氧分压,增加氧的溶解度。罐压用压力变送器将发酵罐的压力转化为电信号接入控制系统。
(7) 转速:
搅拌转速和搅拌功率:对于采用变频系统的发酵罐,其转速、电机电流和搅拌功率等参数可以从变频器通过标准信号或通讯方式获取;对于无变频系统的发酵罐,转速和电流、搅拌功率采用独立传感器进行测量。
(8) 其它辅助因素:
总空气温度、湿度对空气过滤器的效率和发酵水平都有着较大的影响,有必要对其进行检测和控制。
三、CTN-2000医药生产过程控制系统
CTN-2000医药生产过程控制系统,是以美国Honeywell(霍尼韦尔)公司生产的 HC900中小型集散控制系统的软、硬件平台为基础,配合我中心针对医药生产行业特点设计的计量补料装置、气动隔膜控制阀门、专用多功能配电器、接口电路和标准软件模块,以及现场模拟屏显示或数显大屏组成的生产过程测控系统。系统先进、可靠性高、稳定性好、系统构成灵活,极易满足现场各种生产规摸的需要,具有很高的性能价格比。
CTN-2000医药生产过程控制系统可广泛地应用在多种抗生素的生产过程控制中,例如:青霉素、头孢C、土霉素、洁霉素、维生素C、庆大霉素、妥布霉素、金霉素、红霉素、麦白霉素、螺旋霉素等品种,在实际应用中均取得了显著的经济效益。
系统特点:
·先进性、可靠性: HC900控制器为美国原装进口,经过长期现场运行检验,极为可靠,是目前最先进的集散控制系统之一。
·灵活性、可扩展性: 控制器模板品种丰富,功能齐全,利于灵活地构筑系统。模块化结构,使系统扩展非常容易。
·系统功能优秀、齐全: 数据采集、集成数据库管理、报警管理、历史数据存档、趋势曲线显示、事件汇总及报表打印等均能快速准确的实现。
·用户界面友好、操作简便: 系统运行在Windows 2000/XP操作系统环境下,支持中文操作,画面美观大方,操作提示明显,利于使用。
·网络、通讯功能强大: 该系统支持以太网 TCP/IP 通讯,即可以组成对等网络,也可以组成基于Client/Server结构的监控与网络集成,极有利于过程控制系统和生产管理系统的联网。
·现场模拟大屏显示,流程清晰、数据明亮,更具现代气派。
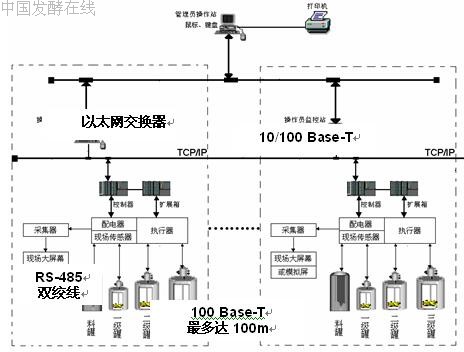
控制系统结构示意图
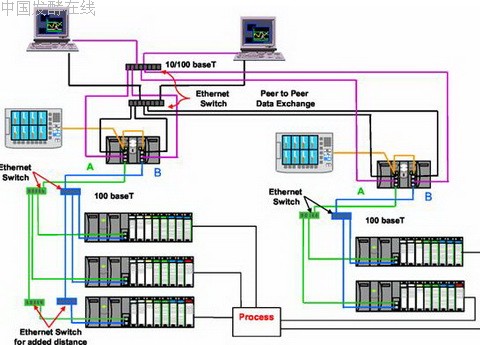
2005年4月份,Honeywell公司推出了冗余HC900控制系统,在适当增加投资的前提下进一步提高了系统的可靠性,结构框图如下所示:
CTN-2000系统是我中心这些年来在发酵行业主推的控制系统,已成功应用于数十家国内制药企业的近百个大型项目,为用户带来了显著的经济效益和社会效益。
