对一个新的材料管理系统或新的ERP系统进行验证是项目实施中的重要步骤。本文以Weleda公司为例,说明了计算机验证ERP系统可以为一个中型制药企业带来怎样的机遇。
目前,Weleda公司在瑞士和德国的三个分公司引进了一个ERP系统:微软商务管理解决方案—Axapta(Microsoft Business Solution-Axapta)。截止发稿,第一个分公司已开始使用这个新系统进行工作,其余两个分公司正在系统运行的筹备过程中。Columbus IT Partner瑞士分公司与Circon Circle Consulting公司作为合作者参与了该项目,此外,DHC (Dr. Herterich & Consultants)公司作为计算机验证的咨询公司也参与其中。
该ERP项目的目标为:
更替使用至今的旧ERP系统功能;
重新组织企业内部流程;
用基于过程的方法建立企业过程结构。
V模型与验证
对于在计算机支持下能够对产品质量产生影响的系统,必须通过欧盟药品生产质量管理规范指南(GMP)、成品药与原料药生产条例(AMWHV)、21 CFR Part 11的验证。也就是说,对于这些符合预期目标的系统,例如电子跟踪批号能力或批量提货,都必须出具书面证明。这些系统在应用时不得产生任何对病人不利的影响。关于计算机验证的详细说明可参见GAMP——优良自动化生产规范。
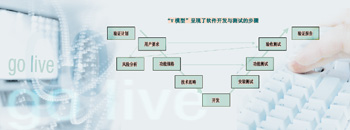
V模型是一种用于软件开发与测试的阶梯状模型。它由分支的左上角开始:第一步是由经过挑选的、该系统的未来用户制定出用户需求标准(User Requirement Specification,URS)。URS在德语中通常被称为“用户要求说明书”。接下来的第二步,是系统编写者制订“功能规格说明书”,又称“功能设计标准(Functional Specification,FS)”,供应商在其中描述了如何将用户要求编入系统。
技术规范(TS)详细描述了将用户要求编入系统的过程,TS是连接系统咨询顾问与软件开发者的纽带。软件开发者在此基础上对系统进行编程和配置,之后进行初步测试。
完成这些步骤以后,V模型图的走势转而向上:测试阶段开始了。风险分析中确定了要测试的内容。在受GMP调节的范围中,至少应测试所有与GMP相关的重要功能。功能测试首先由系统供应商进行。这个阶段(包括排除有风险的故障)结束后,由用户进行功能验收测试,这两个测试都是对各功能块进行检查。接下来就是在整合测试中对完整的商务案例进行检查,例如哪些流程贯穿了生产规划、订货、到货、出货整个过程。此外,测试范围还包括权限测试与数据迁移测试。只有完成了所有测试(除了少数无风险的故障以外),并具有了其他先决条件(如对用户进行培训),才能将该系统付诸使用。交付使用需要有正式的手续。
项目步骤的实施
项目第一步就是审核供应商。系统供应商的QS质量安全体系会在编写软件时得到审查。只有在制定用户需求标准与功能设计标准以后,才能进行编程,这是决定产品质量的一个步骤。即使记录这两个标准的文件之间可能有些不符,供应商还是必须有结构化的行动方案。除了测试QS质量安全体系,我们还强烈建议,在审核的范围内也应严格询问供应商的计算机验证具体经验、对相关规定的接受程度,并设置情景进行测试。
此外,从客户的角度出发,还必须将一部分审核用于测试该项目管理系统,以及测试该系统供应商具有哪些相关经验、如何对用户进行培训。
项目的首个GMP相关文件是验证计划。其中描述了验证方法、V模型的运用以及项目结构。验证的职责应在项目管理者中进行确定。作为一个良好的验证计划,其优点在于,它提供了一种项目手册,通过其中规定的计划和它在项目中所起的作用,既保证了项目实施的透明度,又形成了一种约束力。因此它必须由所有参与者许可后通过。
如今,在许多专题文件中,用户需求(URS)、实现这些需求的方式(FS)以及这些需求在技术上的实现(TS)都被依次写入。这看起来很麻烦,对于众多参与者来说也极为死板。但这种做法也带来了很大的好处:对于该项目内部的企业人员以及外部的项目合作者来说,项目内容都是一目了然,并且具有约束力。大家所商定的内容便于理解,并且都能够在熟悉的文件中找到,不会分散在电子邮件或其它类似文档中。这就为项目今后生命周期中可能出现的系统改动奠定了良好的基础。这个经验说明了一个较为理想的方法:用户与系统供应商在有关过程的专题研讨会上共同制订URS与FS,并制成文件。这个方法可以尽量避免今后产生对于用户需求及其解决方式的误会。此外,对其他解决方法也可以直接进行讨论。文件内容的描述应达到的深度是,即使经过较长一段时间,所有参与者仍然能够在阅读文件时立刻理解其中的内容。
项目工具——风险分析
风险分析是项目实施及验证过程中的有效工具。通过风险分析,可以对与GMP相关功能或高风险的功能进行必要的测试。FMEA(潜在失效模式和后果分析)等传统方法实现了一个结构化基础,这样就可以实现近乎完整的分析,排列出各种措施的先后顺序。风险分析作为项目的控制工具,对于需要考虑人员数量、时间、预算、竞争等因素的项目管理层有很大的帮助。
风险分析的各种测试检查的是已编写的系统的质量,因此必须有充分的时间可供利用。这些行为不应只流于形式,因为只有通过内容合适的测试对软件功能块及数据质量进行检查,才能将风险降到最低程度。用户与项目负责人均能由此获得安全保障,尤其是引进系统以后。除此以外,参与测试的大量用户也会提高对该系统的接受程度。
总的来说,引进经过验证的系统有其益处:一是符合法律规定,这对于制药企业当然是一个重要方面;但更重要的是计算机验证对于结构化且有文件依据的行动方案、各种测试、合格硬件、用户培训均能够保证安全性。“安全”对于制药企业来说,还意味着药品安全,对于病人来说也是如此。
这种安全性要靠费用开支来保证,尤其是文件管理方面,若没有电子系统,管理成本就会非常高昂。此外,理论上的V模型与实际的系统开发之间在许多情况下都会出现问题。风险分析恰好对此非常有益,因为它能够估算出可能产生问题的地方,并在应对措施方面提供支持。因为这种符合验证的行为以步骤化的V模型为基础,所以某个阶段中的任何延误都会推迟下一个阶段的开始,并由此对项目规划产生很大影响。
总而言之,这种在项目实施过程中着眼于过程的行动方案得到了验证工作的支持。其实,V模型清楚明了的结构化规定已经使得项目管理的结构成形了。经过整合的风险分析在很多时候都是很有价值的工具,尤其在项目初期,对于职权的明晰以及人员的交流沟通都特别有利。从前文列举的优点来看,以计算机验证规定为依据的项目实施过程,即使在非GMP调节的行业也能够将风险最小化,并且为保证系统质量作出很大的贡献。
GAMP是准绳
GAMP(优良自动化生产规范)中详细规定了计算机验证的任务。在验证ERP系统时,通常需要进行以下步骤:
审核供应商;
根据V模型循序实施项目,并进行验证;
对用户进行培训。
所有这些步骤必须用文件形式记录下来。