浅谈非最终灭菌产品在除菌过滤工艺方面存在的安全隐患
blueski推荐 [2012-5-7]
出处:blog.milliporechina.com
作者:黄晓龙 顿昕
近年来随着一系列与注射剂有关的药害事件的发生,注射剂的安全问题越来越引起各界人士的广泛关注。由于注射剂的给药方式是直接将药品注射入人体的血液或皮下等部位,,因此如果产品不能保证无菌,将会引起患者的严重不良反应。目前,如何提高注射剂无菌工艺保障水平成为注射剂的研发、生产与监管中的一个关键点。
通常,注射剂的无菌保证工艺有两种:终端灭菌工艺与无菌生产工艺。其中后者主要是在无菌的环境下,通过除菌过滤法或无菌操作法,来保证产品达到一定的无菌水平。因此,在采用除菌过滤的工艺时,如何根据产品的特性选择合适的过滤器,并对其除菌过滤的适应性进行充分的验证就是保证产品能否达到相应的无菌保证水平的关键。在研发与生产的实际中,尚存在一些误区,如不及时加以澄清,将给采用除菌过滤工艺的注射剂带来很大的安全隐患。下面分别介绍三个广泛存在的认识误区。
误认为孔径为0.2 µm或0.22 µm的过滤器都能有效除菌
药品生产所用的过滤器,根据使用的目的一般分成三种: 澄清过滤器、预过滤器和除菌过滤器。这三种过滤器都有0.2 µm这一规格,而且外观一模一样,非专业人士根本无法区分。但从下面所附图谱就可以清楚地分辨出:用于不同目的的过滤器,其内部结构是有很大区别的。事实上,只有除菌过滤器才具有截流细菌的作用,当注射剂采用除菌过滤工艺时,一定要选择除菌级的0.2 µm或0.22 µm过滤器。


在完整性测试方面的误区
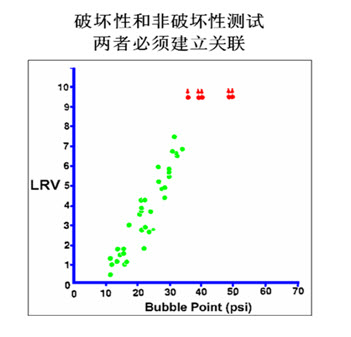
起泡点测试是一种简易的非破坏性的滤器完整性测试方法。由于不同过滤器厂家生产的过滤膜的结构不尽相同,所以合格标准也是不同的。必须通过细菌截流试验证明起泡点的测试标准与过滤器的细菌截流量之间存在线性相关,否则,所制定的起泡点标准就是无效的,不能保证符合该起泡点标准的过滤器能够截流足够量的细菌。下图为滤器的起泡点与细菌截流量之间线性相关图,通过实验所得的该图就可以确立滤器的起泡点标准。
误认为只要提供过滤器出厂时的验证文件(指南)就能保证过滤器的安全
合格的过滤器的生产厂家在过滤器出厂前,会为客户提供一份过滤器的验证文件(指南), 但其验证仅只是以水为介质的, 即将细菌放入水中,然后开始进行挑战试验。这种验证是不够充分的。真正有意义的验证必须满足以下两个条件:
1)应使用实际的药液
2)在最差的工艺条件下进行验证
其原因在于: 1)有些药液会使滤膜的孔径变大,有时也会使细菌变小。例如,在不加某化学试剂的药液中的细菌可以被滤膜有效拦截,而加入该试剂后,细菌就从滤孔中穿透。仅在水中进行细菌截流,无法达到验证的全部目的。2)某些工艺参数会改变过滤效果。例如: 在低压差下,细菌可以被滤膜截留,但增大压差,可能是细菌穿透滤膜。
总之,滤器的选择与验证是保证产品能达到相应的无菌保证水平的关键,应在实际的药品研发过程中避免以上的认识误区,从源头上保证药品的质量。



